Hoy quiero contar una divertida práctica que hemos hecho con alumnos de 2º de E.S.O. Se trata de algo relacionado con la alimentación, y por tanto, con la química. Es evidente que en cualquier producto alimentario la composición química es algo importante, basta con coger la etiqueta, pero muchas veces entender lo que pone es complicado.
Por ejemplo, ¿qué sabemos de los productos lácteos? Porbablemente sólo los tipos que hay: leches, quesos, yogures,… Pero poco más. Quizá algunos saben de sus modos de fabricación y composición básica pero poco más.
La leche (generalmente hablaremos de leche de vaca) , es un fluido líquido que tiene diversos elementos en suspensión, de una manera muy simplificada (un químico o biólogo diría que no es exacto, ruego me disculpen) sería algo así:
- Lactosa (que es un disacárido)
- Lípidos (grasas) de diversos tipos.
- Caseínas (proteínas)
- Suero (la base en la que todo lo anterior está presente)
Casi todas las proteínas y grasas se encuentran en la llamada nata de la leche. Y ése es el producto que vamos a utilizar: nata para montar. ¡Cuidado! No vale la nata para cocinar porque tiene un contenido de grasas mucho más bajo, aproximadamente un 18% frente al 30% de la de montar.
Material:
- Brik pequeño de nata líquida para montar.
- Envase con tapa (tipo tupper)
- Canicas
La práctica es muy sencilla, basta con poner las canicas dentro del envase y poner un poco de nata (no demasiado, lo justo para cubrir las canicas). Entonces comenzamos a agaitar fuertemente el envase. Al principio notaremos las canicas haciendo mucho ruido, pero al poco tiempo el ruido disminuye. Si abrimos el envase veremos que la nata se está montando y es ahora mucho más espesa.
Si seguimos agitando el envase (cerrar primero, no queremos mancharnos demasiado) al poco tiempo podemos volver a mirar y veremos que ahora hay un líquido blanquecino y se han formado unos grumos muy extraños en la nata espesa.
De nuevo cerramos el envase y continuamos agitando. Al poco tiempo volvemos a observar y vemos que el líquido permanece, pero ahora la materia densa no tiene grumos y ha tomado un color amarillento. Sin miedo, cogemos un poco de esa materia y la probamos…¡oh sorpresa! ¡Es mantequilla pura!
¿Qué ha pasado?
Trataremos de explicarlo paso a paso: cuando agitamos el envase con nata y las canicas provocamos el mismo efecto que una batidora: removemos la mezcla por todas partes (si no hubiera canicas y lo hiciesemos sólo agitando el envase el proceso sería muy lento y poco homogéneo). Esto provoca que la nata se monte, que es el primer proceso que ocurre. Tal y como hemos visto hacer en la cocina a nuestros padres y madres.
Pero nosotros no nos quedamos aquí. Continuamos agitando el envase y provocamos que el suero lácteo (también llamado suero de mantequilla) se separe de la mezcla, dejando la materia grasa y proteica casi pura (es decir, una masa de lípidos y caseínas), esos grumos que se forman van desapareciendo cuando se continúa agitando el envase.
Esto se debe a que la leche y la nata se encuentra en una suspensión de materia globular, para que no se quede todo en una mezcla espesa (lo que sucede cuando la leche se estropea o se corta). Estos glóbulos están rodeados de membranas elaboradas de fosfolípidos (ácidos grasos que hacen de emulsionantes) y proteínas, que previenen que la grasa de la leche se apelotone en una masa uniforme. Cuando agitamos la masa provocamos que esos glóbulos se rompan, lo que provoca un daño de las membranas y permite a las grasas de la leche juntarse en una masa única, y separándose al mismo tiempo de otras partes.
Finalmente va tomando de manera natural ese color amarillento (por la presencia de los lípidos) y tenemos una mantequilla pura y fantástica (no contiene conservantes de ningún tipo). Es algo divertido y que sorprende un montón, y que nos permite hablar de cómo se hacen determinados productos lácteos por fermentación, como es el caso del queso o del yogúr.
Y siempre tenemos la posibilidad de prepararnos unas tostadas con esa deliciosa mantequilla, ¿verdad?
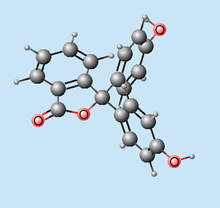

 ), pero lo que nos resulta más desconocido es el curioso efecto que algunos ácidos tienen en esta fórmula, sobre todo el
), pero lo que nos resulta más desconocido es el curioso efecto que algunos ácidos tienen en esta fórmula, sobre todo el 








 )… pero como son extraños y muy difíciles de explicar… hoy los vamos a dejar a parte.
)… pero como son extraños y muy difíciles de explicar… hoy los vamos a dejar a parte.