Respuestas a las preguntas del fin de semana
1.- En las bicicletas, los rayos están montados tangencialmente, mientras que en las carretas están montados radialmente. ¿Por qué?
Los rayos de las carretas sólo deben soportar una fuerza radial, la que ejerce sobre ellos el eje. En cambio, los rayos de las bicicletas, además de esa fuerza radial deben soportar una fuerza tangencial: la que ejerce, a través del eje, la cadena de la bicicleta, naturalmente en la rueda trasera, motriz.
2.- En el interior de un recipiente herméticamente cerrado (a presión normal) colocamos dos vasos iguales. En uno de ellos ponemos agua hasta la mitad y en el otro, también hasta la mitad, echamos agua en la que previamente hemos disuelto una gran cantidad de sal (cloruro sódico). (Para observarlo a simple vista han de pasar 2 o 3 meses) |
Lo que sucederá al cabo del tiempo es que el vaso con agua sola se vacía y el que contiene agua con mucha sal se llena con el agua del otro vaso. Esto se debe a que el vaso de agua sin sal se evapora antes por que la sal retrasa ese fenómeno…además en un ambiente cerrado el agua salada tiende a absorber la humedad presente, por lo que el agua del primer vaso pasa al segundo.
3.- Si colocamos dos latas de una bebida carbonatada una al lado de la otra y las dejamos rodar por una superficie inclinada, llegan al final de forma simultánea.
Sin embargo, si antes de que comiencen a rodar agitamos vigorosamente una de ellas ya no sucede lo mismo.¿Cuál llegará antes? ¿Por qué?
Al realizar la experiencia se comprueba que la lata agitada se retrasa. Es un hecho comprobado que al agitar la lata no aumenta la presión en su interior. Al agitar se forman burbujas en el interior del líquido. Las burbujas formadas entre la superficie del líquido y la lata consiguen que el líquido gire con la lata, facilitando la transferencia de energía cinética de rotación al líquido. Si la lata agitada tiene más energía cinética de rotación, tendrá menos de translación : llegará más tarde.
4.- ¿Cómo es posible que mediante una explosión de dinamita se pueda apagar un incendio en un pozo de petróleo? ¿Por qué el agua apaga el fuego?
El incendio en el pozo se apaga por la falta de oxígeno para continuar la combustión, ésto es debido a que el oxígeno, que es necesario para la combustión es desplazado por la gran cantidad de gases producidos de manera muy rápida por la explosión. En el caso del agua el fenómeno que ocurre es la disminución de la cantidad de calor necesaria para continuar la combustión, ya que al entrar en contacto con el fuego, el agua se evapora y este fenómeno consume una gran cantidad de energía, la cual toma del objeto que en ese momento se esta quemando por lo que al no poder ceder mas calor termina por extinguirse el fuego.

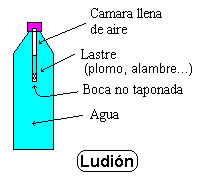




 )… pero como son extraños y muy difíciles de explicar… hoy los vamos a dejar a parte.
)… pero como son extraños y muy difíciles de explicar… hoy los vamos a dejar a parte.